今回は、緩衝溶液に関して解説していきます。
苦手な方はこの記事を読んで原理をマスターしましょう!!
緩衝溶液とは
緩衝溶液の説明をする前に、緩衝溶液についている「緩衝」という言葉の意味について触れます!
「緩衝」は「衝突や衝撃を和らげる」という意味があります。緩衝材(荷物を包むプチプチ)をイメージいただくとわかりやすいと思います。
では化学用語ではどうなるか、というと
緩衝溶液とは、外部からH+やOH-を加えてもpHが変化しない(一定)の溶液を意味します。
外部から違う物質が入ってきても「pH変化を和らげる効果がある」という意味で「緩衝」が名前についています。
緩衝溶液の具体例と原理
緩衝溶液の意味が分かったところで、「どういったものがこれに当てはまるのか」具体例を挙げていきます。
弱酸と弱酸の塩を含む水溶液
まず一つ目が、弱酸と弱酸の塩を含む水溶液です。
(弱酸についてはこちらで解説:【詳しく解説】電離度の求め方・弱酸は本当に電離しにくいのか?)
具体例として、酢酸(CH3COOH、弱酸)と酢酸ナトリウム(CH3COONa、弱酸の塩)を多量に含む溶液があります。
この緩衝溶液が、どのようにpHを一定に保っているかを解説します。
まず、酢酸は水溶液中で式(1)の様な平衡反応式で存在しています。
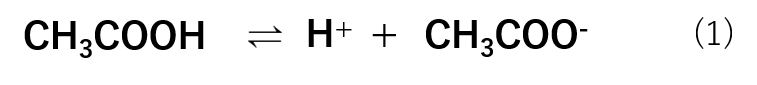
次に、酢酸ナトリウムに関しては、塩なので式(2)の様に完全に解離しています。
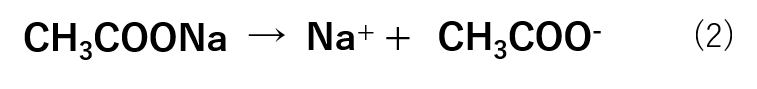
ここで、酢酸ナトリウムを加えたことによりCH3COO–の濃度が増え、式(1)の平衡は左側に移動します。これにより、酢酸の電離はほぼしていない状態とすることができます。
つまり、酢酸と酢酸ナトリウムを含んだ溶液ではCH3COOHとCH3COO–が大量に存在しています。
(平衡反応についてはこちらで解説:酸解離定数とは)
この溶液のpHを変化させようとした際の反応を考えていきましょう。
pHを下げようとした場合
pHを下げようとする場合は水溶液中の水素イオン濃度([H+])を上げればよいので、H+を加えていきます。この場合は式(3)のような反応が進行します。
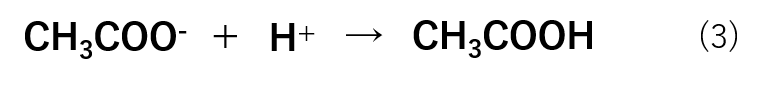
このように、大量に存在するCH3COO–がH+と反応することでH+を加えても水溶液中には残りません。したがって、pHが一定に保たれます。
pHを上げようとした場合
pHを上げようとする場合は水溶液中の水酸化物イオン濃度([OH–])を下げればよいので、OH–を加えていきます。この場合は式(4)のような反応が進行します。
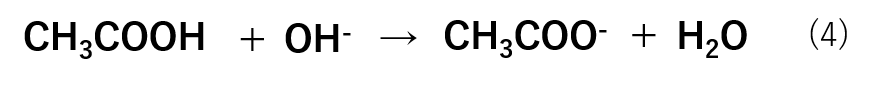
このように、大量に存在するCH3COOHがOH–と反応することでOH–を加えても水溶液中には残りません。したがって、pHが一定に保たれます。
このように共役酸と共役塩基が大量に存在することで、pH変化を抑える効果があります!
(共役酸・共役塩基についてはこちら:【3分で理解】共役酸・共役塩基とは?見分ける方法は?「解説」)
弱塩基と弱塩基の塩を含む水溶液
二つ目は弱塩基と弱塩基の塩を含む水溶液です。
具体例として、アンモニア(NH3、弱塩基)と塩化アンモニウム(NH4Cl、弱塩基の塩)を多量に含む溶液があります。
この緩衝溶液が、どのようにpHを一定に保っているかを解説します。
まず、アンモニアは水溶液中で式(5)の様な平衡反応式で存在しています。
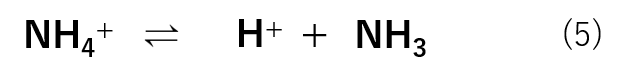
次に、塩化アンモニウムに関しては、塩なので式(6)の様に完全に解離しています。
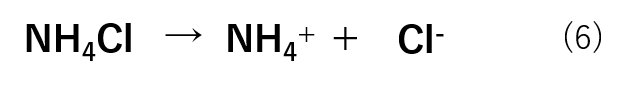
ここで、塩化アンモニウムを加えたことによりNH4+の濃度が増え、式(5)の平衡は左側に移動します。これにより、アンモニアはほとんどがNH3として存在しています。
つまり、アンモニアと塩化アンモニウムを含んだ溶液ではNH3とNH4+が大量に存在しています。
この溶液のpHを変化させようとした際の反応を考えていきましょう。
pHを下げようとした場合
pHを下げようとする場合は水溶液中の水素イオン濃度([H+])を上げればよいので、H+を加えていきます。この場合は式(7)のような反応が進行します。
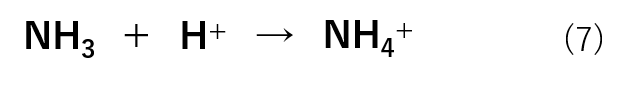
このように、大量に存在するNH3がH+と反応することでH+を加えても水溶液中には残りません。したがって、pHが一定に保たれます。
pHを上げようとした場合
pHを上げようとする場合は水溶液中の水酸化物イオン濃度([OH–])を下げればよいので、OH–を加えていきます。この場合は式(8)のような反応が進行します。
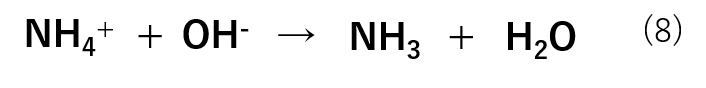
このように、大量に存在するNH4+がOH–と反応することでOH–を加えても水溶液中には残りません。したがって、pHが一定に保たれます。
まとめ
今回の記事では、緩衝溶液とは何かとその原理について解説しました。
まとめると、
・ 緩衝溶液とは、外部からH+やOH-を加えてもpHが変化しない(一定)の溶液 。
・共役酸と共役塩基が水素イオンと水酸化物イオンと反応し、pHを一定に保つ。
最後までご覧いただきありがとうございました!
今回は、緩衝溶液は弱酸と弱酸の塩もしくは弱塩基と弱塩基の塩によってできている。と説明しましたが、実際は弱酸の濃度や水溶液のpHによって変わってきます!詳細は後程解説したいと思います!
リンク:にほんブログ村



コメント