前回の記事(弱酸、強酸の違いについて)で、弱酸と強酸の違いを説明しました。
今回は弱酸は本当に電離しにくいのかについて、電離度を算出して詳しく解説します。
弱酸とは
弱酸とは電離度αが1よりも小さい酸です。強酸(HA1)は式(1)の様にH+とA1–に酸解離(電離)するためHA1が無くなります。これに対して、弱酸(HA2)は式(2)の様に平衡状態で存在します。つまり、HA2の一部がそのままの形で存在しています。
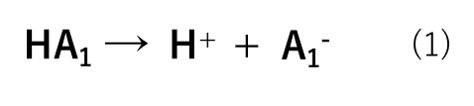
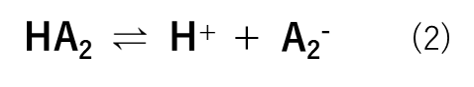
これが一般的な考え方だと思いますが、弱酸は本当に電離しにくいのか?ということを以下で考えていきます
弱酸の電離度を求めてみよう
まず、弱酸が電離した際にどれくらいの割合がHA2のまま存在し、逆にどれくらいの割合がH+やA2–になるのかを解説していきます。
結論から申し上げると、弱酸の電離割合は酸の酸解離定数(Ka)と、酸を溶かす溶液のpHによって決まります。
(酸解離定数に関してはこちらで解説をしています。→酸解離定数とは)
今回は酢酸を例にとって、弱酸が完全には電離していないことを、数値で理解しましょう!
酢酸の電離度(pH 5)
酢酸(CH3COOH、pKa = 4.76)0.01 molをpH 5.0の水溶液 1 Lに溶かした場合を考えていきましょう。(pHは常に一定とする)
(補足ですが、pKa = -log Kaであり、Ka = 10-5 Mの物質はpKaが5になります。)
平衡反応式
まず、酢酸に関して
平衡反応式は式(3)の様に表すことができるため、平衡定数は式(4)の様に表すことができます。
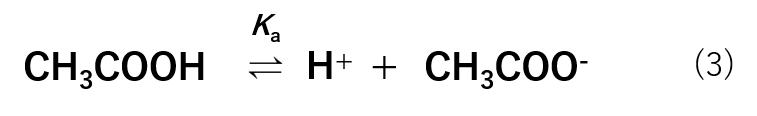
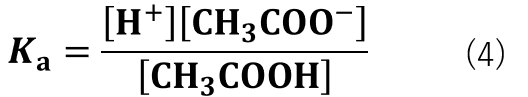
HA2(H+とA2–に電離)に当てはめると、CH3COOH(H+とCH3COO–)です。
電離度
電離度は以下の式(5)

により求めることができます。今回の条件においては、水溶液1 L中に0.01 molの酢酸が溶解しているため、溶液に加えた酢酸の総濃度は0.01 Mです。
ここで、総濃度と書いたのには理由があります。冒頭でも説明した通り、弱酸である酢酸は完全には電離しません。つまり、[CH3COOH]と[CH3COO–]の足し合わせた濃度が0.01Mとなります。そのため、電離した濃度である[CH3COO–]を求めることができれば、目的である「電離度」を算出することができます。
[CH3COO–]と[CH3COOH] を求めるために式(4)を変形していきます。
式の変形、代入
(酢酸の総濃度)= [CH3COO–] + [CH3COOH] =0.01 Mより、 [CH3COOH] =0.01 – [CH3COO–] なので式(4)は
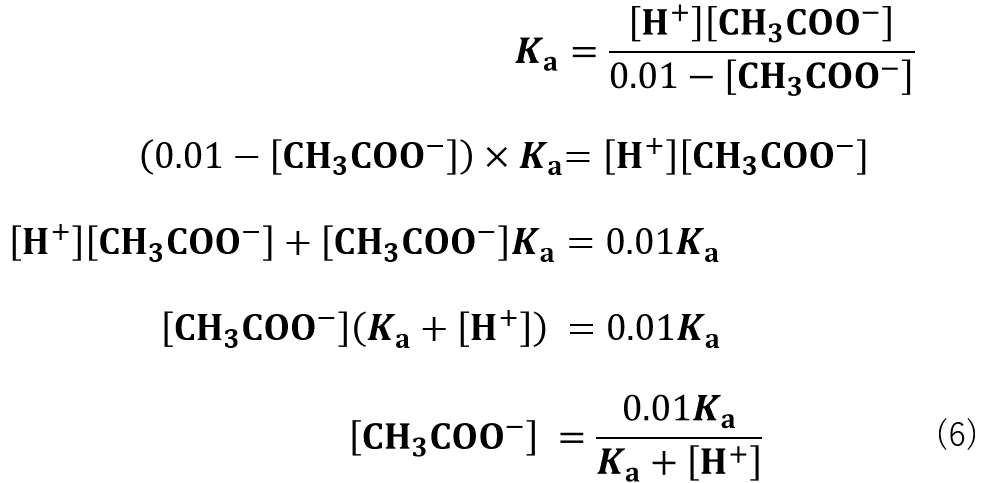
式(6)に変形することができます。
ここで、pH = 5を仮定しているため、[H+] = 10-5 Mです。
また、Ka = 10-4.76 M (pKa = 4.76より)ということも分かっています。
これらを式(6)に代入すると
[CH3COO–] = 0.0064 Mとなります。
電離度を算出する式(5)より,電離度は0.64となります。%表記だと、64%が電離していることになります。
以上のことから弱酸は水溶液中で完全には解離していないことが、数値として証明されました。
pHを変えると電離度はどう変わる?
先程までは、pH 5の水溶液中において酢酸がどれくらい電離するのかを解説しました。
お気づきの方もいるかもしれませんが、式(6)中に[H+]が含まれていることからも、pHを変えると[CH3COO– ]が変化します。つまりはpH変化によって酢酸の電離度が変化するのです!
以下で、pH変化による電離度を計算してみます。
pH 7の場合
pH = 7を仮定しているため、[H+] = 10-7 M
Ka = 10-4.76 M (pKa = 4.76より)
式(6)に代入すると、 [CH3COO–] = 0.0099 Mとなります。
電離度を算出する式(5)より,電離度は0.99となります。%表記だと、99%が電離していることになります。
pH5とは大きく異なり電離度がほぼ1になりました。
pH3の場合
pH = 3を仮定しているため、[H+] = 10-3 M
Ka = 10-4.76 M (pKa = 4.76より)
式(6)に代入すると、 [CH3COO–] = 0.00018 Mとなります。
電離度を算出する式(5)より,電離度は0.018となります。%表記だと、1.8%が電離していることになります。
pH5、pH7の時とは大きく異なり、今度は電離度が0に近づきました。
図で視覚化すると
次に、横軸を溶液のpH、縦軸を酢酸の電離度とした曲線の図をご覧ください。
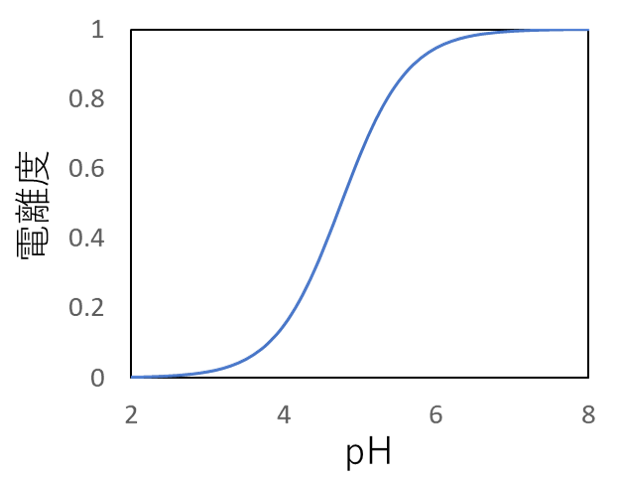
このように、溶液のpHによって酢酸の電離度は大きく変化していくことが分かります。
以上のことから、「弱酸は電離しにくい」という考え方は間違っており、厳密には「溶液のpHによっては電離しにくい」という考え方が正しいです。
強酸に関しては溶液のpHに関係なく電離度は1です。
今回はpHの変化に伴う電離度を算出していきましたが、物質が変われば酸解離定数(Ka)も変わるため、電離度の曲線は左右に平行移動します。
まとめ
今回は弱酸は本当に電離しにくいのかという問題に対して、溶液中でどのような反応が起きているのかを考え、電離割合を計算することで解説しました。
まとめると、
・弱酸はpH、酸解離定数(Ka)によって電離度が決まる。
ご覧いただきありがとうございました!
次回は、弱酸の電離度に関連する「緩衝溶液について」解説したいと思います。
リンク:にほんブログ村



コメント