今回の記事では平衡定数・化学平衡について解説していきます!
化学平衡
平衡定数を理解するうえで重要なのが化学平衡です。
はじめに化学平衡について、酢酸を例にとって説明します。
酢酸は水溶液中において式(1)のような反応式で存在します。
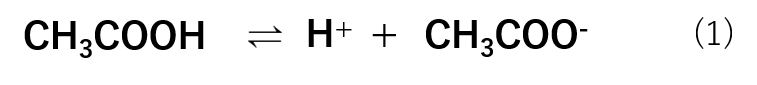
この式において反応の方向を表す矢印が両方向に出ていますね!
これは、正反応と逆反応が両方存在することを表しています。
この正反応(右側に向かう反応)と逆反応(左側に向かう反応)の反応速度が等しいとき、その状態を平衡状態と言います。
この状態の時、反応速度は等しいのでCH3COOH、CH3COO–、H+の濃度は変化しません。
これは、平衡状態の特徴です。
平衡定数
化学平衡を解説したところで、平衡定数についても触れていきます!
平衡定数は反応がどれくらい進みやすいかを表す定数です。
酢酸
先程の酢酸の電離反応を平衡定数(Ka)で表すと式(2)の様になります。
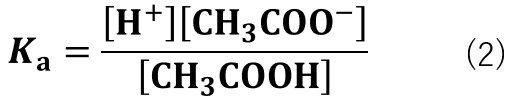
平衡定数は「定数」であるため、溶液の中に他の物質が入ったとしても一定の数値で表されます。
一般的な反応式
酢酸の電離反応以外の反応に関しても平衡定数で表すことができます。
式(3)のような反応を例にとると、平衡定数(K)は式(4)の様に表すことができます。
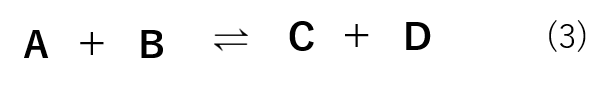
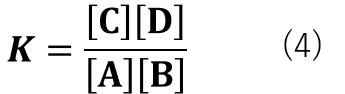
反応の右側と左側の物質が何種類でも同様に平衡定数(K)の式を表すことができ、
式(5)のような反応を例にとると、平衡定数は式(6)の様に表すことができます。
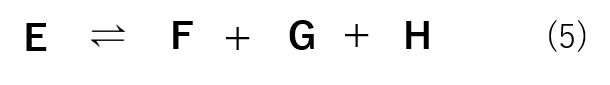
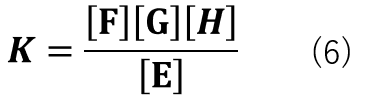
まとめ
今回の記事では、平衡定数・化学平衡に関して解説しました!
まとめると
・ 正反応(右側に向かう反応)と逆反応(左側に向かう反応)の反応速度が等しいとき、その状態を平衡状態という。
・平衡定数は「定数」であるため、溶液の中に他の物質が入ったとしても一定の数値で表される。
最後までご覧頂きありがとうございました!
化学平衡についてはこちらでも触れているのでぜひご覧ください!↓
(【詳しく解説】緩衝溶液とは?原理をマスター)
※化学平衡を理解するうえで重要な「反応速度」の解説は割愛したため、今後解説をする予定です。



コメント