今回の記事では、化学反応の反応速度に関して解説していきます!
反応速度とは
まず反応速度とは何かについて説明します。
反応速度とは化学反応における反応物・生成物の濃度の単位時間当たりの変化量を表す単位です。
式で表すと式(1)のようになります。

反応速度
例えば、以下の化学反応式(2)を例にとって考えてみましょう。
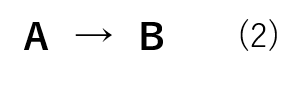
反応物の減少量
まず、反応物Aに着目して時間経過に伴う濃度の変化を見ていきましょう。
ここで、時刻 t1 における反応物Aの濃度を[A]1、時刻 t2 における反応物Aの濃度を[A]2とおくと、反応式(2)の反応速度は式(3)の様に表されます。
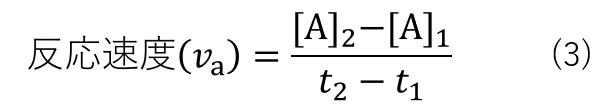
生成物の増加量
次に、生成物Bに着目して時間経過に伴う濃度の変化を見ていきましょう。
ここで、時刻 t1 における生成物Bの濃度を[B]1、時刻 t2 における生成物Bの濃度を[B]2とおくと、反応式(2)の反応速度は式(4)の様に表されます。
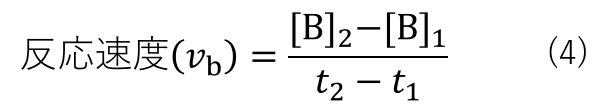
反応物と生成物の反応速度の関係
反応式(2)のように反応式の係数が等しい場合、反応速度の絶対値は等しくなります。(式(5))

一方で、反応式の係数が異なる場合、反応速度の絶対値は係数の比に等しくなります。
ここでは、炭酸水素ナトリウム(NaHCO3)が炭酸ナトリウム(Na2CO3)・水(H2O)・二酸化炭素(CO2)に分解する反応を例にとって解説します。
反応式は式(6)の様になります。
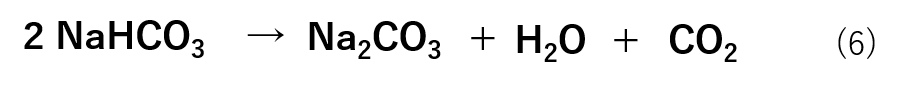
この反応式から、炭酸水素ナトリウム(NaHCO3)2molが分解されることで炭酸ナトリウム(Na2CO3)1mol・水(H2O)1mol・二酸化炭素(CO2)1molが生成することが分かります。
つまり、反応速度の比は
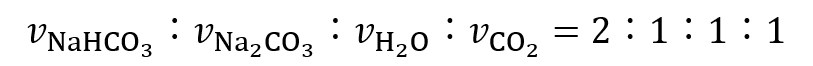
であるため、反応速度の関係は式(7)の様になります。
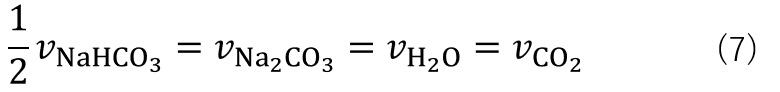
反応速度を変化させるには
化学反応の反応速度は様々な要因で変化します。今回は、反応速度が変化する要因の中で代表的なものを3つご紹介します。
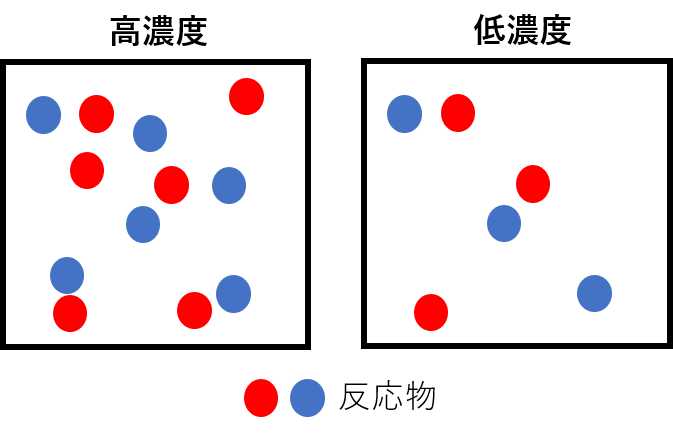
反応物の濃度を変化させる
化学反応は、反応物どうしが衝突することで生成物ができます。濃度を大きくすると衝突する確率が大きくなるため、反応速度が大きくなります。逆に、濃度を小さくすると衝突する確率が小さくなるため、反応速度が小さくなります。
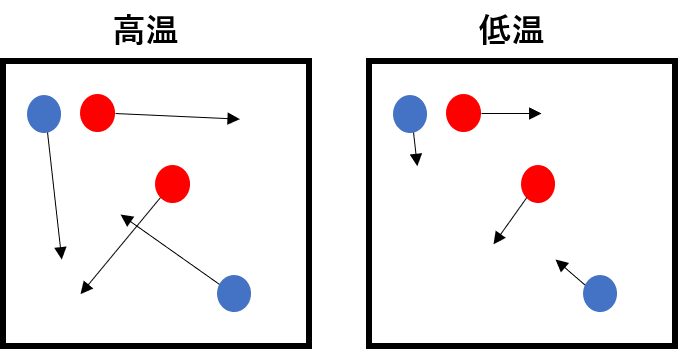
温度を変化させる
反応物は自由に動き回っており、温度が高いほどより激しく動き回るようになります。これにより、反応物どうしが衝突する確率が高くなるため、反応速度が大きくなります。逆に、温度を小さくすると反応物の動きが鈍くなるため、反応物どうしが衝突する確率は小さくなり反応速度が小さくなります。
触媒を加える
反応物が生成物へと反応する場合、活性化エネルギーと呼ばれるエネルギー障壁を越えなければなりません。エネルギー障壁が高い状態だと、反応物が生成物へと変化する確率が低いため反応速度は小さいです。
一方で、触媒を加えることにより活性化エネルギーを低くすることができます。これによりエネルギー障壁が低くなるため、反応物が生成物へと変化する確率が高くなり反応速度が大きくなります。
まとめ
今回の記事では、化学反応の反応速度について解説しました。
まとめると、
・ 反応速度とは化学反応における反応物・生成物の濃度の単位時間当たりの変化量を表す単位
・ 反応式の次数が等しい場合、反応速度の絶対値は等しくなる。
・ 反応式の次数が異なる場合、反応速度の絶対値は次数の比に等しくなる。
・温度変化、濃度変化、触媒によって反応速度は変化する。
いかがでしたか?最後までご覧いただきありがとうございました!日々精進!



コメント