今回の記事は溶解度積とは何か、沈殿平衡について解説していきます!
溶液内の平衡反応に関するお話が続きますね。よろしければ他の記事もご参考ください!
(【詳しく解説】緩衝溶液とは?原理をマスター、【詳しく解説】電離度の求め方・弱酸は本当に電離しにくいのか?)
溶解度積とは
まず初めに、溶解度積とは何かを説明していきます。
溶解度積とは「イオンが沈殿するかを決める値であり、陽イオンと陰イオンの濃度の積(掛け算)」です。
イオンって沈殿するの!?と思った方もいるかもしれませんが、塩化ナトリウムや塩酸のように溶けやすい物質ばかりではありません。溶解度積は、ほんのわずかな濃度のイオンでも沈殿が生成する物質(塩)に適用されることが多いです。
以下で具体例を見ていきましょう。
塩化銀の溶解度積・沈殿生成
塩化銀(AgCl)を例にとって具体例を挙げて考えていきます。
AgClは難溶性の塩として知られており、これらのイオン(Ag+、Cl–)が水溶液中にわずかに存在するだけでも沈殿を生成します。
水溶液中においては式(1)のような平衡反応式で存在します。
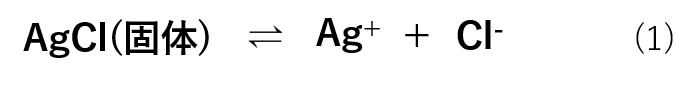
また、平衡定数(K)は式(2)の様に表すことができます。
(平衡定数についてはこちら:【高校化学】平衡定数・化学平衡とは「解説」)
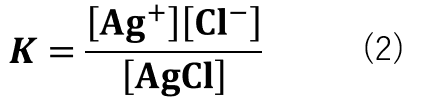
式(2)において、難溶性の塩の場合は分母の値がほぼ一定であるため(難溶性塩はわずかな濃度でも沈殿を生成するために、AgClの濃度は常に飽和している。)
式(2)は式(3)の様に変形することができます。
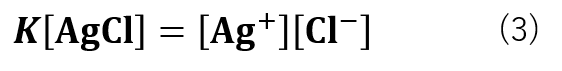
Kと[AgCl]はどちらも定数であるため、K[AgCl] = Kspとすると、式(4)の様になります。
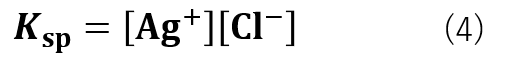
このKspが溶解度積です。
[Ag+][Cl–]の値がKspよりも大きいか・小さいかによって沈殿の生成が決定します。
以下でそれぞれの場合を解説していきます。
Ksp ≧ [Ag+][Cl–]の場合
[Ag+][Cl–]とがKspが式(5)の大小関係の場合、沈殿は生成しません。
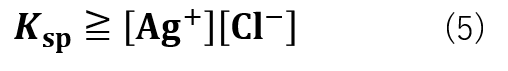
これは、[Ag+]と[Cl–]の濃度が低く、Ksp ≧ [Ag+][Cl–]の関係にある時は「難溶性の塩の場合は分母の値がほぼ一定であるため」という仮定が成り立たなくなるので、沈殿が生成しない平衡反応として取り扱う必要があるためです。
(沈殿が生成しない平衡反応:【高校化学】平衡定数・化学平衡とは「解説」)
Ksp < [Ag+][Cl–]の場合
[Ag+][Cl–]とがKspが式(6)の大小関係の場合、沈殿が生成します。
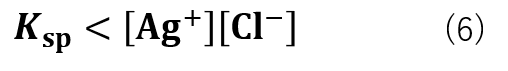
これは、Ksp = [Ag+][Cl–] の関係性を保つために溶液内で反応が進行するためです。
もう少し詳しく述べると、[Ag+]もしくは[Cl–]の濃度が増えると、増えた分の濃度をもとに戻そうとするため、式(1)の平衡反応式において平衡が左側に傾きます。これにより、AgClの沈殿が生成します。
まとめ
今回の記事では、溶解度積・沈殿平衡について解説しました。
まとめると、
・ 溶解度積とは「イオンが沈殿するかを決める値であり、陽イオンと陰イオンの濃度の積(掛け算)」。
・Kspよりもイオン濃度の積が大きい時は沈殿しない。
・Kspよりもイオン濃度の積が小さい時は沈殿する。
いかがでしたか?最後までご覧いただきありがとうございました!



コメント