今回は、共役酸・共役塩基とは何か、それらを見分ける方法について解説していきます!
共役とは
酸・塩基という言葉は耳にしたことがあるかと思います。しかし、そこに「共役」が付くとたちまち見慣れない言葉になってしまいます。しかし、安心してください!
まずは、この「共役」の意味を説明します。
共役とは、「対」「ペア」を意味する言葉であります。
例えば「右と左」であったり、「男と女」といったような関係をイメージしていただければと思います。(例えに自信はないですが、、笑)
この意味をもとに、実際に共役酸・共役塩基に当てはめて考えてみましょう。
共役酸・共役塩基
今回は酢酸(CH3COOH)を例にとって考えていきます。
酢酸は水溶液中において電離し、式(1)のような反応が生じます。これにより、CH3COOHとCH3COO–が同時に存在しています。
(酢酸の電離について詳しくはこちら【詳しく解説】電離度の求め方・弱酸は本当に電離しにくいのか?)

CH3COOHが共役酸、CH3COO–が共役塩基であります。
CH3COOHとCH3COO–のように、共役酸と共役塩基は[H+]が付いているか・付いていないかで対の存在になっています。
共役酸・共役塩基の見分け方
ここで、「対になっている2つの内、どちらが共役酸でどちらが共役塩基となるの?」という疑問が出てきます。
これについて解説していきます。
結論から申し上げると、
・もとの物質からH+を取り除いたものが共役塩基(もとの物質は共役酸)
・もとの物質にH+を付けたものが共役酸(もとの物質は共役塩基)
です。
先程の式(1)においてはもとの物質(CH3COOH)からH+を取り除くことで、CH3COO–ができています。
つまりH+を取り除いた CH3COO– が共役塩基であり、もとの物質である CH3COOH が共役酸です。
アンモニアの共役酸・共役塩基
つぎにアンモニアを例にとって考えていきましょう。
アンモニアは水溶液中で式(2)のような反応式で存在します。
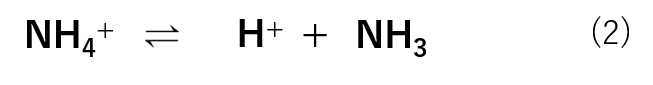
この反応において、もとの物質(NH4+)からH+を取り除くことで、NH3ができています。
つまりH+を取り除いた NH3 が共役塩基であり、もとの物質である NH4+ が共役酸です。
まとめ
今回の記事では共役酸・共役塩基とは何か、それらを見分ける方法について解説しました。
まとめると
・共役酸・共役塩基はH+が付いているか、付いていないかで「対」になっている物質
・もとの物質からH+を取り除いたものが共役塩基(もとの物質は共役酸)
・もとの物質にH+を付けたものが共役酸(もとの物質は共役塩基)
理解することができましたか?最後までご覧いただきありがとうございました!
↓基礎固めにお勧めです!
リンク:にほんブログ村



コメント