今回の記事では、共有結合に関してルイス構造の観点から解説します!
分子を理解するうえで、重要な知識となりますのでこれを機にしっかり覚えましょう!
共有結合とは
共有結合は化学結合の一種であり、隣り合った2個の原子が1対の電子を共有することで形成される結合です。すなわち、電子対がどこに存在し、2つの原子間で何対共有しているかが重要になります!
共有結合の種類
共有結合はいくつの対の電子が共有されているかで結合様式が変わります。
単結合
単結合は1対の電子を共有することで形成されます。

(例:水素分子 H2)
二重結合
二重結合は2対の電子を共有することで形成されます。
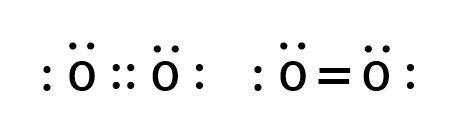
(例:酸素分子 O2)
ここで、共有されずに1つの原子上に残っている価電子の対を孤立電子対あるいは非共有電子対と言います。
三重結合
三重結合は3対の電子を共有することで形成されます。
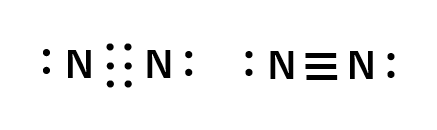
(例:窒素分子 N2)
オクテット則
それではどのように電子対が存在しているかを以下で解説していきます!
オクテット則とは
オクテット則は物理化学者ルイスが発見した法則であり、電子対がどのように存在するかを示す法則です。多くの分子は以下の法則で説明可能です。
「各原子はその価電子が計8個(オクテット)になるように隣り合う原子と電子を共有する。」
先程の酸素原子と窒素原子で確認してみると
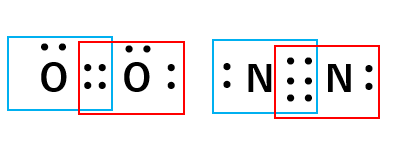
それぞれの原子の価電子が8個であることが確認できます。この法則は、その他の分子においても当てはまります。
(ここで、1s軌道を有する水素原子はデュプレット則(価電子2個)に従うため例外である。)
ルイス構造
オクテット則により、一定の法則に基づいて電子対が存在することが分かりました。
「電子対をどのように図示すればよいのか」を示したのがルイス構造であります。
ここまでの解説でも、分子の結合状態をルイス構造により示しておりましたが、改めて解説すると
・結合をつくっている電子対は線で表す。(二重結合の場合は二重線、三重結合の場合は三重線)
・非共有電子対は点で表す。
共鳴
分子によっては、ルイス構造は1つだけではなく複数の構造で表すことがあります。
このように複数の構造で表される状態を共鳴といいます。
オゾン分子
オゾン(O3)を例にとって解説していきます。
O3をルイス構造で図示すると以下の様になります。
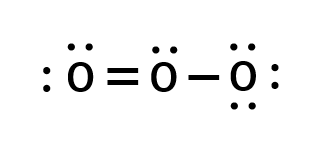
ルイス構造においては、単結合と二重結合が一つづつ存在している様に表されており、それぞれの結合が別のものである様に思えます。実際には二つの結合は等価であり、結合長も等しいです。
具体的には約128pmであり、酸素の単結合(121pm)と二重結合(141pm)の間の結合長を有します。
以上のように、1つのルイス構造で図示するのが不都合である際は、複数のルイス構造を用いることで、分子が共鳴して存在している状態を図示します。
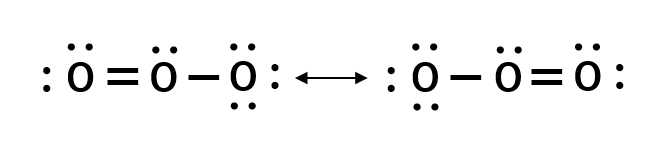
オゾンは、上記のように共鳴した状態で存在し、それぞれのルイス構造の重ね合わせ(平均)が実際の分子構造であります。
まとめ
今回の記事では 共有結合に関してルイス構造の観点から解説 しました。
まとめると
・共有結合は化学結合の一種であり、隣り合った2個の原子が1対の電子を共有することで形成される結
・共有されずに1つの原子上に残っている価電子の対を孤立電子対あるいは非共有電子対と言う。
・共有結合は、オクテット則により「各原子はその価電子が計8個(オクテット)になるように隣り合う原子と電子を共有する。」
・共鳴は複数のルイス構造を用いて表され、それぞれの重ね合わせが実際の分子構造である。
いかがでしたか?最後までご覧いただきありがとうございました!
↓定期テスト対策はこちら!



コメント