今回の記事では、沸点上昇と凝固点降下について解説していきます!
分かりやすく解説するのでぜひ最後までご覧ください!
沸点上昇
水溶液の沸点
水の沸点は100℃であるということは皆さん知っているかと思いますが(水の状態変化についてはこちら)、水に溶質を溶かすと沸点が変わるのをご存じですか!?
例えば,ショ糖水溶液の沸点は濃度が0.5 mol/kgの時100.26℃であり,さらに濃度を上げ1.0 mol/kgの時は100.52℃となります。
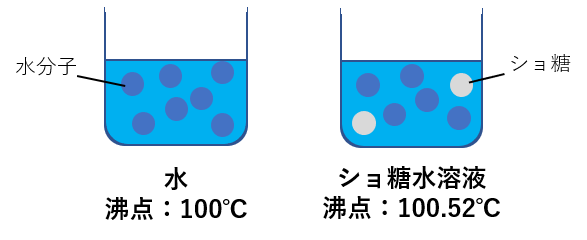
このように、ショ糖や塩化ナトリウム(NaCl)など蒸発しにくい溶質が解けている水溶液の沸点は、水だけの沸点よりも高くなります。この現象を沸点上昇と言います。
沸点上昇の原理
それではなぜ、水溶液の沸点は上昇するのでしょうか?
それは、水溶液の蒸気圧が関係してきます。
液体の沸点とは、液体の蒸気圧が外圧(大気圧)と等しくなる温度であります。
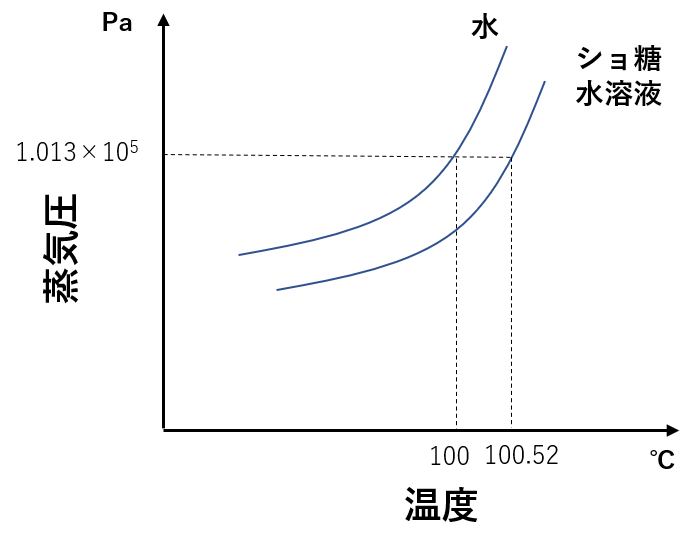
通常の水の場合、蒸気圧曲線に従い,1.013×105Paの大気圧との交点が沸点になります。
一方で、水溶液の蒸気圧曲線は普通の水よりも下側に存在するため(蒸気圧降下),1.013×105Paの大気圧との交点は100℃よりも高くなります。
このように、溶質を溶かした水溶液の沸点は通常の水よりも高くなります。
蒸気圧降下の原理
先程、蒸気圧降下により結果として沸点上昇が生じるという事を解説しましが、そもそも「なぜ蒸気圧降下が起こるのか」について簡単に説明します。
溶質が溶けている水溶液は、表面に水分子のほかに溶質分子が存在しています。そのため、通常の水と比べて水分子が蒸発する可能性が低くなります。つまり、その分だけ蒸気圧が下がります。
溶質の濃度が大きくなるほど、表面の水分子の割合が低くなり、蒸気圧が降下します。その結果として、濃度の高い水溶液は沸点上昇が大きくなります。
沸点の求め方
ショ糖水溶液(非電解質)の場合
先程、ショ糖の沸点は濃度が0.5 mol/kgの時100.26℃であり,さらに濃度を上げ1.0 mol/kgの時は100.52℃となるという事を述べましたが、どれくらい沸点上昇するかは以下の様に求めることが出来ます。
水の沸点を100℃,ショ糖水溶液の沸点を100+Δt℃とします。この時、沸点はΔt℃上昇したことになります。
Δtを沸点上昇度と呼び、式(1)で表すことが出来ます。
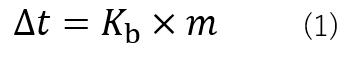
ここで、Kbは溶媒によって決まる比例定数でありモル沸点上昇と呼びます。水の場合0.52 K・kg/molであります。
mは質量モル濃度であり, 0.5mol/kg と仮定して計算してみましょう。
0.5mol/kgのショ糖水溶液の沸点上昇度は
Δt = 0.52×0.5 = 0.26℃
したがって、ショ糖水溶液の沸点は100+0.26 = 100.2℃となります。
塩化ナトリウム水溶液(電解質)の場合
塩化ナトリウムを水溶液に溶かした場合の沸点上昇度はどうなるでしょうか?
結論から述べると、0.5 mol/kgの塩化ナトリウム水溶液の沸点は100.52℃であります。
沸点上昇度に換算すると0.52℃であり,0.5mol/kgのショ糖水溶液と比べて2倍となっています。
これは、塩化ナトリウムは式(2)のように水溶液中でNa+とCl-に電離することが原因です。
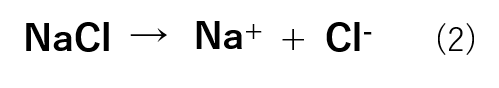
0.5mol/kgのNaClが電離したことにより,水溶液中には0.5mol/kgのNa+と0.5mol/kgのCl-が存在し、二つを合わせると1.0mol/kgとなります。したがって,
Δt = 0.52×1.0 = 0.52℃
となります。
凝固点降下
水溶液の凝固点
次に、凝固点に関しても解説をしていきます!
ご存じの通り、水の凝固点は0℃です。水に溶質を溶かすと凝固点が低下します。
例えば、ショ糖水溶液の凝固点は0.5mol/kgの時-0.93℃,1.0mol/kgの時-1.86℃であります。

このように、ショ糖や塩化ナトリウム(NaCl)など蒸発しにくい溶質が解けている水溶液の凝固点は、水だけの凝固点よりも低くなります。この現象を凝固点降下と言います。
凝固点降下の原理
それではなぜ凝固点が低くなるのでしょうか?
それは、水溶液中に存在する溶質が原因です。水(液体)が氷(固体)に状態変化する現象が凝固であります。普通の水の場合0℃になると水分子が氷を形成していきます(一カ所に集まるイメージ)。
一方で、水溶液中に溶質が存在すると、水分子が一カ所に集まる際に溶質分子が邪魔をします。それにより、凝固がしにくくなります。つまり凝固点が低下します。
凝固点の求め方
先程、ショ糖の凝固点は濃度が0.5 mol/kgの時-0.93℃であり,さらに濃度を上げ1.0 mol/kgの時は-1.86℃となるという事を述べましたが、どれくらい凝固点降下するかは以下の様に求めることが出来ます。
水の凝固点を0℃,ショ糖水溶液の凝固点を0-Δt℃とします。この時、凝固点はΔt℃降下したことになります。
Δtを凝固点降下度と呼び、式(3)で表すことが出来ます。
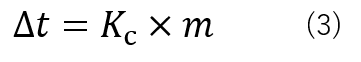
ここで、Kcは溶媒によって決まる比例定数でありモル凝固点降下と呼びます。水の場合1.86 K・kg/molであります。
mは質量モル濃度であり, 0.5mol/kg と仮定して計算してみましょう。
0.5mol/kgのショ糖水溶液の凝固点降下度は
Δt = 1.86×0.5 = 0.93℃
したがって、ショ糖水溶液の沸点は0-0.93 = -0.93℃となります。
塩化ナトリウム水溶液(電解質)の場合
塩化ナトリウムを水溶液に溶かした場合の凝固点降下度はどうなるでしょうか?
結論から述べると、0.5 mol/kgの塩化ナトリウム水溶液の凝固点は-1.86℃であります。
凝固点降下度に換算すると1.86℃であり,0.5mol/kgのショ糖水溶液と比べて2倍となっています。
これは、沸点上昇の際と同様に、塩化ナトリウムは水溶液中で式(2)のようにNa+とCl–に電離することが原因です。
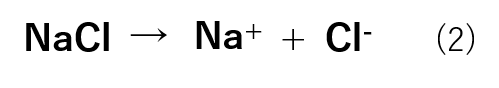
0.5mol/kgのNaClが電離したことにより,水溶液中には0.5mol/kgのNa+と0.5mol/kgのCl–が存在し、二つを合わせると1.0mol/kgとなります。したがって,
Δt = 1.86×1.0 = 1.86℃
となります。
まとめ
今回の記事では、沸点上昇と凝固点降下に関して、原理と計算例を解説しました!
まとめると
・水溶液の沸点が水よりも高くなることを沸点上昇、凝固点が低くなることを凝固点降下と呼ぶ。
・沸点上昇は溶質の濃度が大きくなるほど上昇度が大きくなり、凝固点降下は溶質の濃度が小さくなるほど降下度が大きくなる(凝固点が下がる)。
いかがでしたか?最後までご覧いただきありがとうございました!
定期テスト対策はこちら!↓



コメント