今回の記事ではエンタルピーとエントロピーの違いについて解説していきます!
語感が似ているため中々覚えずらいと感じる人も多いと思います。
少し、物理的な側面も含みますが分かりやすく解説するので、ぜひ最後までご覧ください!
エンタルピーとは
エンタルピーは、一般的にHで表されます。
一言であらわすとエネルギーです。
エンタルピーは内部エネルギー(U)と圧力(P)、体積(V)で式(1)のように定義されます。
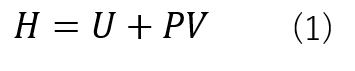
ここで、内部エネルギーは物質の運動エネルギーを表すのに対して、エンタルピーは外部とのエネルギーのやり取りを含めた式であります。特に、物質の熱量に関わる指標として用いられることが多いです。
例えば、等圧条件下において、
・外部に熱を放出するとエンタルピーは小さくなる。
・外部から熱を受け取るとエンタルピーが大きくなる。
エントロピーとは
次に、エントロピーについて解説します。
エントロピーとは「乱雑さ」を示す指標であります。一般的にはSを用いて表されます。
「乱雑さ」と言われても理解しにくいかと思いますので、イメージ図をご覧ください!
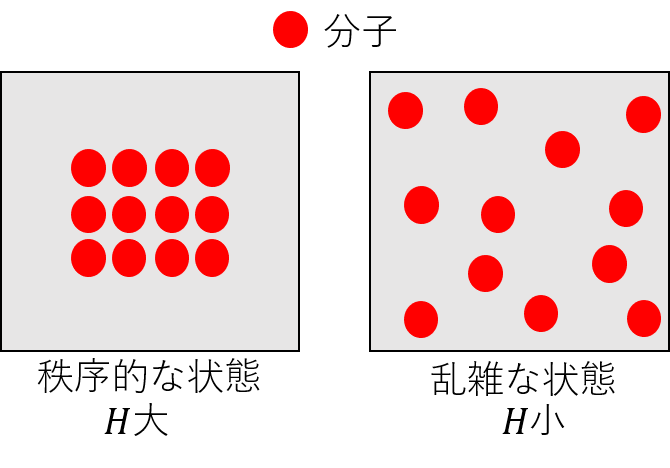
図の左側は分子がまとまって存在し、「秩序的な」状態であります。一方で、右側は分子が分散して存在しており、「乱雑な」状態であることが分かります。
「秩序的な」状態の時はエントロピーが高く、「乱雑な」状態の時はエントロピーが小さいです。
自然界においては、【常に】エントロピーが高い状態からエントロピーが低い状態に変化していきます。この状態変化は不可逆的であります。つまり、何らかの外力を用いない限りは、「秩序的な」状態から「乱雑な」状態へと変化し、その逆へは変化していかないのです。
例:水の中に角砂糖を溶かす
まだ、分かりにくいかと思いますので身近な事象を例にとって考えていきましょう!
【例】水の中に角砂糖を入れた時の状態を考えてみましょう。
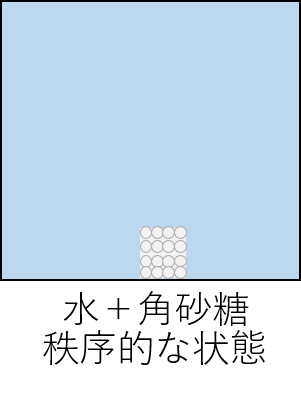
水の中に角砂糖を入れた直後は、砂糖はまとまって存在しています。これがエントロピーが高い状態であり、いわゆる「秩序的な」状態です。
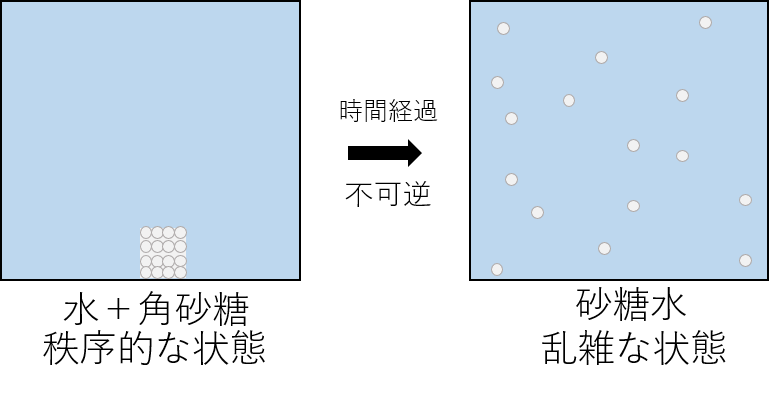
時間が経過するとどうなるでしょうか?
砂糖は水に溶けるため、均一に散らばり砂糖水となります。この状態がエントロピーが低い状態であり、いわゆる「乱雑な」状態です。
水の中の角砂糖は時間経過とともに「秩序的な」角砂糖の状態から「乱雑な」砂糖水の状態へと変化しました。一方で、「砂糖水」を何時間、何年間と放置しても「角砂糖と水」へと戻ることはありません。これがエントロピー変化が不可逆であることの実例です。
まとめ
今回の記事では、エンタルピーとエンタルピーの違いを解説しました!
まとめると、
・エンタルピーはエネルギーの一種であり、熱量を表す指標である。
・エントロピーは「乱雑さ」を表す指標であり、自然界におけるエントロピー変化は不可逆的である。
いかがでしたか?最後までご覧いただきありがとうございました!
↓基礎固めにおすすめです!




コメント