今回の記事では、化学反応の反応速度式について解説していきます。
前回の記事では反応速度とは何か?について触れましたが、今回の記事では反応速度式を解くことで積分系速度式を導出し「化学反応における物質濃度の時間依存性」を見ていきたいと思います!
反応速度式とは
まず、反応速度式とは何かを解説していきます。
化学反応における反応速度式とは「反応速度と反応物の濃度および定数パラメーターの関係式」です。ここで、以下の簡単な反応式(1)を例にとります。
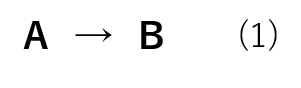
この反応の反応速度式は以下の式(2)、式(3)で表されます。
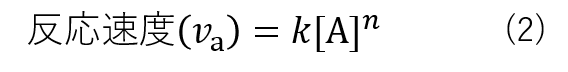
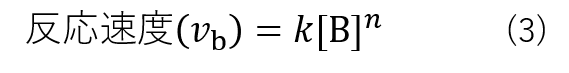
ここで、kは速度定数であり反応の種類や温度によって決まるパラメーターです。nは反応次数であり実験的に算出することができます。
反応式(1)において時間経過とともにAがBに変わる反応が進行するため、A、Bそれぞれの濃度の時間依存性は以下の図の様になります。
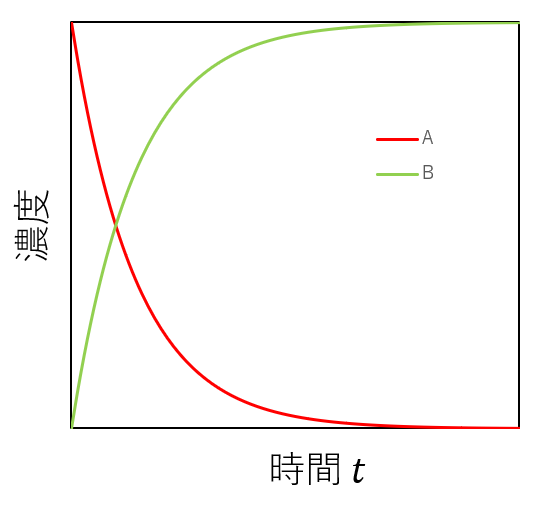
この図からもわかるように、速い反応とはAの濃度減少またはBの濃度増加の時間あたりの変化量が大きい反応であり、遅い反応はその逆であります。つまり、濃度の時間微分量が反応速度となります。
以上より、Aの消費速度およびBの生成速度は微分方程式(4)、(5)で表すことができます。
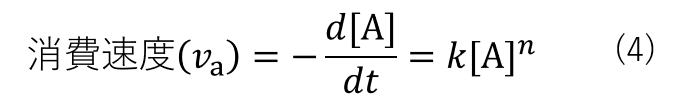
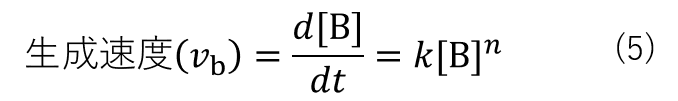
積分系速度式
ここまでの解説で、反応速度を微分方程式で表せることが分かりました。
ここからは、 濃度の時間依存性を表す式である積分系速度式を導出します。積分系速度式を導出することにより、図1のように「ある反応中における物質の濃度がどのように変化するか」を自身で描くことができます。
一次反応の場合
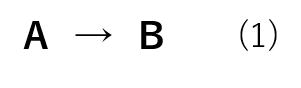
反応式(1)が一次反応の場合、反応速度の微分方程式は式(6)の様に表されます。
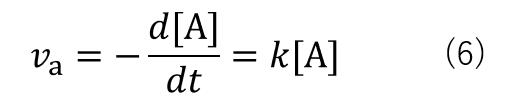
変形すると式(7)になります。
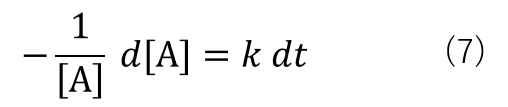
ここで、t = 0のときの反応物[A]の濃度を[A]0、t = t(任意の時間)のときの反応物[A]の濃度を[A]tと置き、t =0からt = tにかけて積分すると、式(8)に変形することができます。(積分系速度式)
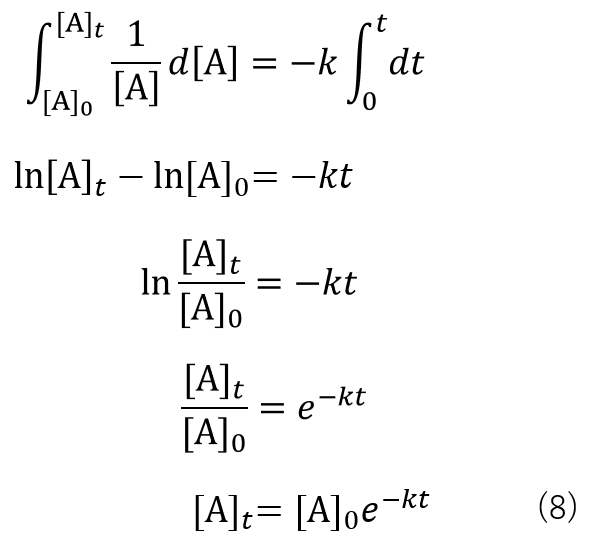
式(8)を用いて、Aの濃度の時間依存性を図示すると以下の様になります。
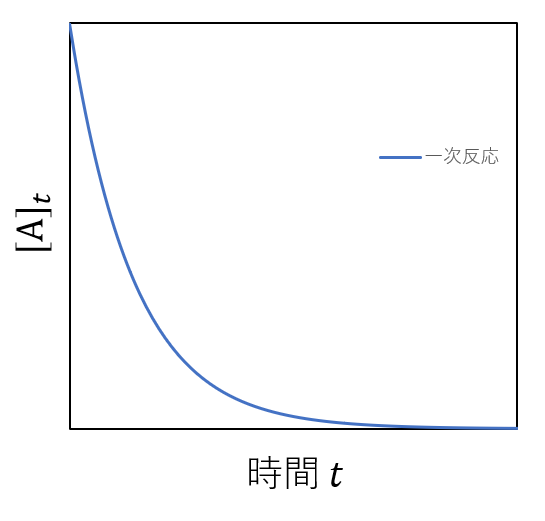
このように、一次反応においては反応初期にAの濃度が大きく減少します。
二次反応の場合
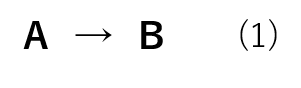
反応式(1)が二次反応の場合、反応速度の微分方程式は式(9)の様に表されます。
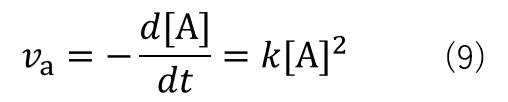
変形すると式(10)になります。
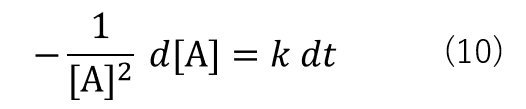
一次反応と同様に、積分系速度式に変形すると、式(11)になります。
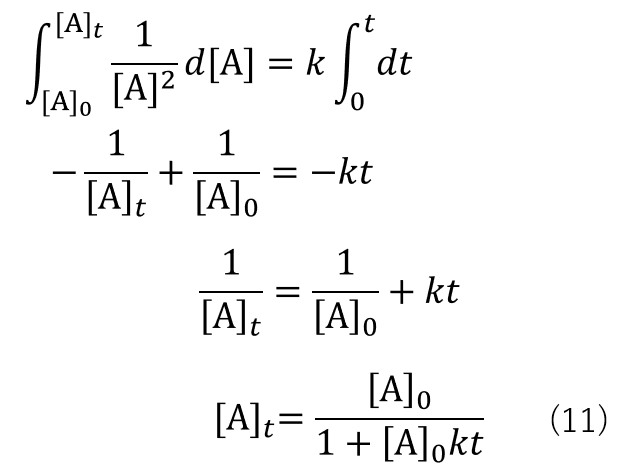
式(11)を用いて、Aの濃度の時間依存性を図示すると以下の様になります。
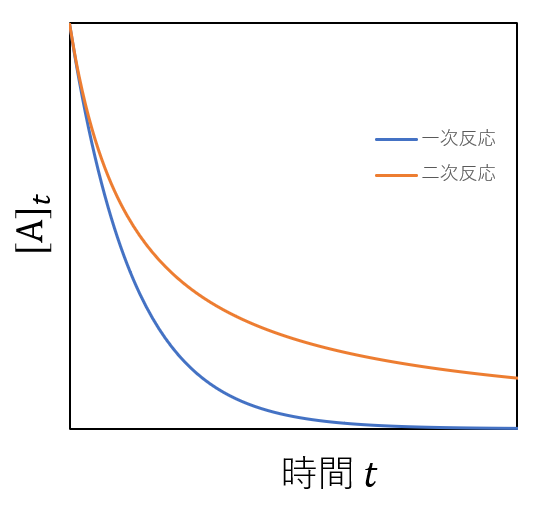
先程の一次反応の濃度変化と比較すると、Aの濃度減少が緩やかになったのが確認できます。
このように、反応次数によって反応物の濃度変化は変わります。(温度等の反応条件でも変わってきます。)
まとめ
今回の記事では 化学反応の反応速度式について解説しました。
まとめると
・反応速度式とは「反応速度と反応物の濃度および定数パラメーターの関係式」である。
・ 積分系速度式を導出することにより「ある反応中における物質の濃度がどのように変化するか」追うことができる。
・反応次数によって反応物の濃度変化は変わる。
いかがでしたか?最後までご覧いただきありがとうございました!



コメント