今回の記事では、反応速度を活性化エネルギーの観点から解説していきます!
以前も反応速度については違った観点から解説してるので、良かったらご覧ください!
(【詳しく解説】反応速度とは「化学・解説」,【分かりやすく】反応速度式とは【大学化学】)
活性化エネルギー
まず初めに、反応速度と密接な関係がある活性化エネルギーを解説します。
身の回りには様々な物質が存在しますが、それらは「最も安定」な状態として存在するわけではありません。
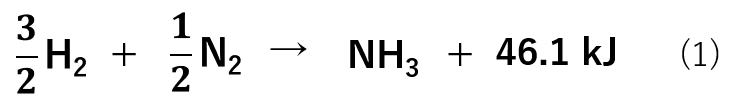
例えば、アンモニア(NH3)はN2およびH2よりも安定であります。
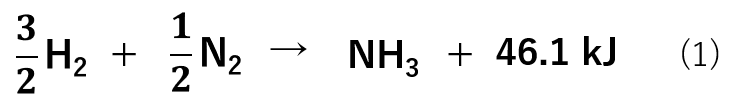
反応式(1)からも分かるように、アンモニアの生成熱は正です。つまり、N2およびH2として存在するよりもNH3として存在する方が安定なことを示しています。
しかし、普段生活している中で、空気中にアンモニアが突然できる事は無いと思います。
これは、化学反応には活性化エネルギーが存在するためです。
活性化エネルギーは反応の「山」に例えられ、「山」を越えるだけのエネルギーが無ければ、より安定である生成物へと変化することができません。
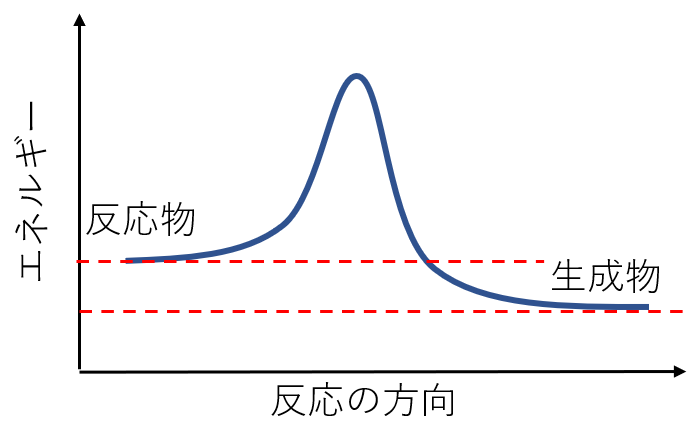
活性化エネルギーが高ければ高いほど、反応物から生成物への反応に必要なエネルギーが大きいことを示し,高温高圧や電流を流すといった激しい条件でないと反応が進行しないことを意味します。
逆に、活性化エネルギーが低ければ低いほど反応物から生成物への反応に必要なエネルギーは小さいことを示し、低温でも反応が進行します。
触媒
アンモニアは、様々な産業で利用されている物質であります。
一方で、その活性化エネルギーが高いため、加熱や電流を流すといった大量のエネルギーを必要とし、生産コストが課題となっていました。
その課題を解決するために開発されたものが触媒です。
触媒は活性化エネルギーを小さくする効果があります。(厳密には触媒を用いることで違う反応経路を経由する。)
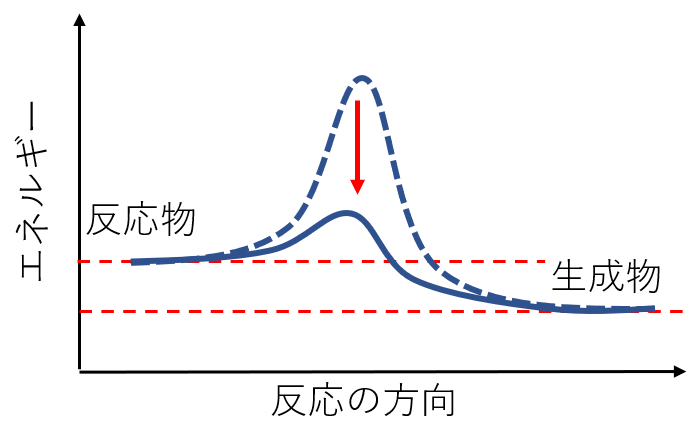
アンモニアの場合、鉄を触媒とすることで活性化エネルギーが大きく減少し、効率的に生産を行えるようになりました。(ハーバー・ボッシュ法)
触媒は金属だけに限りません。私たちに最も身近な触媒は酵素です。食べ物を消化する際やアルコールを分解する際には体内に存在する酵素が活性化エネルギーを低下させることで、消化や分解といった体内の「化学反応」を容易にしてくれます。
反応速度
反応速度式
水素と窒素からアンモニアが生成する反応(1)について
反応速度(v)は反応速度定数(k)を用いて式(2)の様に表すことが出来ます。(詳しくはこちら)
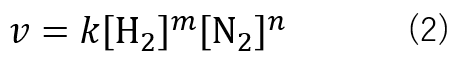
このように、反応の速さを反応物質の濃度で表した式を反応速度式と言います。
ここで、反応速度定数(k)は比例定数であり、温度や反応によって固有の値であります。
反応速度定数と活性化エネルギーの関係
反応速度定数についてもう少し詳しく見ていきましょう。
反応速度定数は式(3)のように表すことができ、これをアレニウスの式と言います。
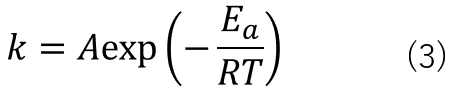
式(3)中でAは頻度因子(分子構造に関係する定数)、Tは温度、Rは気体定数、Eaは活性化エネルギーです。
温度一定の条件では、活性化エネルギーが小さいほどkは大きくなり、活性化エネルギーが大きいほどkは小さくなります。
つまり、活性化エネルギーが小さいほど反応速度が速いことを意味します。
先程の、アンモニアの触媒反応を思い出してみましょう。触媒無しの条件では活性化エネルギーが高いため反応速度は遅く反応はほとんど進行しません。触媒を用いることで活性化エネルギーが低下し、反応速度が速くなるため反応がすぐに進行する様になります。
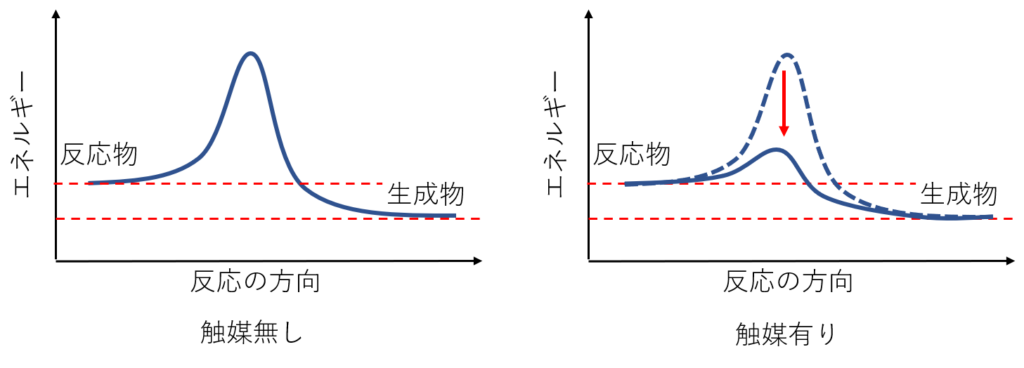
鋭い人は気づいたかもしれませんが、触媒無しの条件下でも反応が遅いだけで全く反応しないわけではありません。実は、人間では気づかないほどの速度・量のアンモニアは身の回りに存在しています。
まとめ
今回の記事では反応速度を活性化エネルギーの観点から解説しました!
まとめると
・ 活性化エネルギーが高ければ高いほど、反応物から生成物への反応に必なエネルギーが大きい。
・ 活性化エネルギーが低ければ低いほど反応物から生成物への反応に必要なエネルギーは小さい。
・触媒は活性化エネルギーを小さくする効果がある。
・活性化エネルギーが小さいほど反応速度が速い
いかがでしたか?最後までご覧いただきありがとうございました!
↓定期テスト対策はこちら!



コメント