このページでは弱酸と強酸の違いについて解説していきます。結論から申し上げると、電離度が大きな物質は強酸であり、電離度が小さな物質は弱酸です!
電離度とは
それでは、重要なキーワードである電離度から説明していきます。
酸をHAと表した時、水溶液中では式(1)の様に反応します。
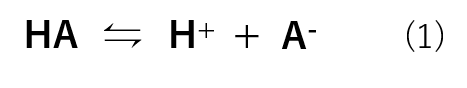
ここで、HAが電離してH+とA–になった割合を電離度といい,一般的にαで表します。αは式(2)の様に表されます。
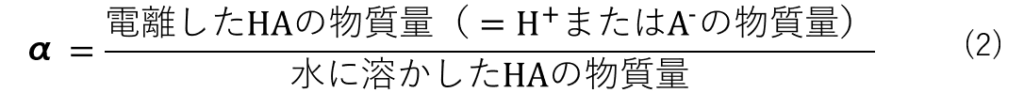
弱酸・強酸の違い
それでは、弱酸と強酸では電離度αがどのように違うかを見ていきます。
強酸
αが1に近い時は水中にいれた物質がほぼ全て電離していることを表し、その物質は強酸であると言えます。例えば、塩酸(HCl)を水中に加えた時はH+とCl–に完全に電離します。
弱酸
これに対して、αが1より小さい時は、水中に入れた物質の全てが電離するわけではないことを意味します。つまり、その物質は弱酸であると言えます。例えば、酢酸(H3COOH)を水中に加えた時には、一部がH+とH3COO–に電離しますが、一部はH3COOHのままで存在しています。
ここまでは酸を例にとって弱酸と強酸の違いについて説明してきましたが、強塩基の場合も同様に考えて問題ありません。αが1に近い塩基は強塩基であり、αが1よりも小さい塩基は弱塩基です。
まとめ
最後に弱酸・強酸についてまとめます。
・弱酸と強酸の違いは、電離度αによって決まる。
・αは物質を水に溶かした際に電離する割合である。
・αが1に近いと酸を強酸という。
・αが1よりも小さい酸を弱酸という。
最後までご覧いただきありがとうございます!
次回は弱酸の電離度についてさらに詳しく解説します。
【詳しく解説】電離度の求め方・弱酸は本当に電離しにくいのか?
↓定期テスト対策はこちら!
リンク
リンク:にほんブログ村



コメント